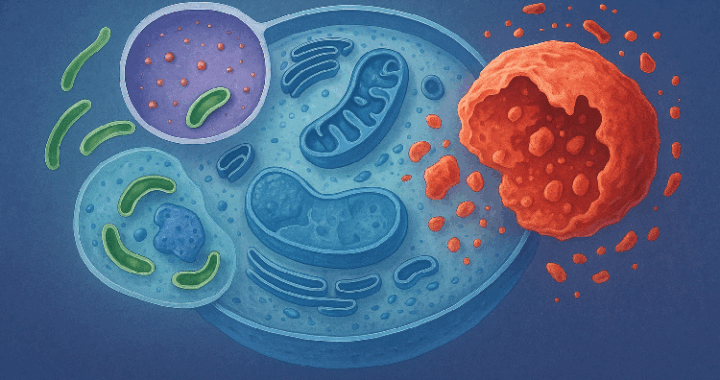
Dans l’univers fascinant des processus biologiques de la cellule, l’autophagie et l’apoptose jouent des rôles essentiels dans le maintien de l’homéostasie cellulaire et la préservation de la santé globale de l’organisme. Bien que ces mécanismes aient des fonctions distinctes, leur interaction complexe est au cœur de nombreux processus physiopathologiques, notamment dans la régulation de l’inflammation, du vieillissement cellulaire, et des maladies dégénératives.
Cet article se propose d’explorer les rôles spécifiques de l’autophagie et de l’apoptose, leurs liens, leurs bienfaits thérapeutiques et leurs implications dans le maintien de la santé, notamment au niveau de l’intestin. Nous ferons également un point sur les dangers des solutions délétères qui perturbent ces mécanismes et comment un retour à un équilibre biologique naturel pourrait constituer une approche préventive efficace.
Autophagie et Apoptose : Définitions et mécanismes
L’Autophagie : Le mécanisme de dégradation cellulaire
L’autophagie, du grec « auto » (soi) et « phagein » (manger), est un processus cellulaire essentiel où la cellule se dégrade elle-même pour recycler ses composants internes. Ce mécanisme permet de maintenir l’homéostasie cellulaire en éliminant les organelles endommagées, les protéines mal repliées ou excédentaires, ainsi que les agents pathogènes intrus. L’autophagie se déroule dans des structures appelées autophagosomes, qui fusionnent ensuite avec les lysosomes pour digérer le contenu cellulaire.
L’autophagie joue un rôle très important dans la gestion du stress cellulaire, qu’il soit induit par des toxines, un manque de nutriments, ou des lésions génétiques. Elle est régulée par des voies de signalisation complexes impliquant des protéines comme mTOR (mammalian target of rapamycin) et AMPK (AMP-activated protein kinase), qui modulent l’activation de ce processus en fonction des conditions internes de la cellule.
L’Apoptose : La mort cellulaire programmée
L’apoptose, souvent appelée « mort cellulaire programmée », est un processus biochimique par lequel une cellule se suicide de manière ordonnée et régulée. Contrairement à la nécrose, qui est une mort cellulaire accidentelle et pathologique souvent associée à une inflammation, l’apoptose est un mécanisme précis, nécessaire à l’homéostasie tissulaire.
Ce processus implique une série de signaux intracellulaires qui conduisent à l’activation de caspases, des enzymes responsables de la dégradation contrôlée de composants cellulaires, menant à la fragmentation de la cellule sans inflammation. L’apoptose est cruciale dans de nombreux processus physiologiques, notamment la morphogenèse embryonnaire, la régulation du système immunitaire et l’élimination des cellules potentiellement cancéreuses.
Autophagie et Apoptose : Distinctions importantes
Malgré leurs rôles complémentaires dans le maintien de la santé cellulaire, l’autophagie et l’apoptose sont des mécanismes distincts, mais interconnectés.
L’autophagie : Un mécanisme de survie
L’autophagie est principalement un mécanisme de survie cellulaire. En période de stress, elle permet à la cellule de se protéger contre les dommages en éliminant les éléments nuisibles. Si l’autophagie échoue à maintenir l’homéostasie, cela peut mener à des dysfonctionnements cellulaires ou à des pathologies telles que les maladies neurodégénératives.L’apoptose : Un mécanisme de destruction
En revanche, l’apoptose est un mécanisme destiné à éliminer les cellules endommagées, mutées ou inutiles, évitant ainsi l’accumulation de cellules anormales qui pourraient entraîner des tumeurs ou des maladies auto-immunes. Dans certains contextes, comme les cancers, l’apoptose est bloquée pour permettre la prolifération des cellules cancéreuses.
Ces deux processus sont donc opposés dans leurs buts immédiats : l’autophagie vise à sauver la cellule, tandis que l’apoptose vise à éliminer définitivement les cellules dysfonctionnelles. Cependant, il existe des points de convergence. Par exemple, une autophagie excessive ou insuffisante peut déclencher des signaux apoptotiques en cas de dommages trop importants, ce qui illustre la relation intime entre ces deux mécanismes.
A lire aussi >>>>>Guide complet pour débuter le jeûne<<<<<
Liens entre Autophagie et Apoptose : Un pont de communication cellulaire
Les interactions entre autophagie et apoptose sont multiples et parfois contradictoires. En effet, dans certaines circonstances, l’autophagie peut précéder l’apoptose. Par exemple, en réponse à un stress cellulaire extrême (comme une hypoxie prolongée), l’autophagie permet de protéger la cellule pendant un certain temps, mais si la capacité d’autophagie est insuffisante pour éliminer les dommages, l’apoptose peut être activée pour éviter que la cellule endommagée ne persiste et ne devienne une menace pour l’organisme.
Inversement, une cellule qui active trop rapidement l’apoptose sans passer par un processus d’autophagie pourrait manquer l’opportunité de se réparer et d’éliminer les dommages de façon plus sélective. Ce dialogue entre les deux mécanismes est essentiel pour éviter les maladies telles que le cancer, les maladies neurodégénératives, et les maladies cardiovasculaires.
Bienfaits thérapeutiques de l’Autophagie et de l’Apoptose
Autophagie et santé : Un outil de prévention et de traitement
L’autophagie joue un rôle crucial dans le nettoyage cellulaire et la régénération, notamment au niveau des tissus vieillissants ou endommagés. Une stimulation modérée de l’autophagie pourrait offrir des bienfaits thérapeutiques dans diverses pathologies, notamment :
Maladies neurodégénératives : L’autophagie permet d’éliminer les protéines mal repliées ou les agrégats protéiques, processus essentiel dans des maladies comme la maladie de Parkinson, la maladie d’Alzheimer, ou la sclérose latérale amyotrophique (SLA). La stimulation de l’autophagie pourrait donc avoir un rôle dans la prévention ou le ralentissement de ces affections.
Cancer : L’autophagie est un processus à double tranchant dans le cancer : elle peut empêcher la transformation maligne des cellules en éliminant les agents pathogènes ou en réduisant l’inflammation, mais elle peut également permettre aux cellules tumorales de survivre dans des conditions de stress sévère. De ce fait, une modulation ciblée de l’autophagie représente une piste thérapeutique prometteuse dans la lutte contre le cancer.
Vieillissement et métabolisme : L’autophagie est associée à un ralentissement du vieillissement cellulaire. En éliminant les débris cellulaires et en régénérant les mitochondries, elle contribue à maintenir la fonction cellulaire à long terme.
Apoptose et thérapie : De la protection à l’éradication des cellules anormales
L’apoptose est également essentielle à la régulation de la santé. En éliminant les cellules endommagées ou potentiellement cancéreuses, elle protège l’organisme contre l’accumulation de mutations et l’apparition de tumeurs.
Cancer : De nombreux traitements anticancéreux, tels que la chimiothérapie et la radiothérapie, visent à induire l’apoptose dans les cellules tumorales. Cependant, certaines cellules cancéreuses développent des mécanismes pour échapper à l’apoptose, rendant ces traitements moins efficaces. Des stratégies visant à réactiver l’apoptose dans ces cellules peuvent donc renforcer l’efficacité des thérapies.
Infections virales et immunité : L’apoptose est également un mécanisme important dans la lutte contre les infections virales. En éliminant les cellules infectées, elle empêche la propagation du virus dans l’organisme.
L’intestin et la balance cellulaire
Les cellules de l’intestin, particulièrement les entérocytes, sont exposées à des agressions constantes, que ce soit par des agents pathogènes, des toxines ou des inflammations chroniques. Ici aussi, l’autophagie et l’apoptose jouent un rôle central :
Autophagie intestinale : L’autophagie dans les cellules intestinales permet de maintenir l’intégrité de la barrière intestinale, un processus important pour prévenir les pathologies inflammatoires intestinales comme la maladie de Crohn ou la colite ulcéreuse.
Apoptose intestinale : Un contrôle précis de l’apoptose dans l’intestin est essentiel pour maintenir un équilibre entre la prolifération cellulaire et la mort cellulaire. En cas de dérèglement, des troubles tels que les cancers colorectaux peuvent survenir.
Les dangers des solutions délétères
Les solutions thérapeutiques modernes peuvent parfois perturber ces mécanismes naturels. Les traitements chimiques, l’utilisation excessive d’antibiotiques, et même certains régimes alimentaires déséquilibrés peuvent altérer l’équilibre délicat entre autophagie et apoptose.
Médicaments et perturbation de l’autophagie : Certains médicaments, comme les inhibiteurs de mTOR, qui sont utilisés dans le traitement de certaines affections, peuvent empêcher l’autophagie de fonctionner correctement. Bien que ces traitements aient leurs bénéfices dans certains contextes, leur utilisation à long terme pourrait rendre l’organisme moins capable de se régénérer et de se protéger contre les dommages cellulaires.
Antibiotiques et microbiote intestinal : Les antibiotiques, bien que salvateurs dans les infections aiguës, peuvent également détruire la flore intestinale bénéfique. Un microbiote intestinal perturbé altère l’autophagie dans les cellules intestinales, ce qui peut favoriser l’inflammation chronique et rendre l’intestin plus vulnérable aux maladies auto-immunes ou aux troubles digestifs.
Nutrition et déséquilibre métabolique : Un régime alimentaire trop riche en sucres et en graisses, combiné à un mode de vie sédentaire, peut induire un stress oxydatif et une inflammation chronique, ce qui perturbe à la fois l’autophagie et l’apoptose. Un excès de sucres et de graisses peut également inhiber les voies de signalisation de l’autophagie, et, par conséquent, limiter la capacité des cellules à se débarrasser des déchets et des toxines.
Ces perturbations des mécanismes biologiques naturels peuvent entraîner un dérèglement de l’équilibre cellulaire, favorisant le développement de maladies dégénératives, de cancers, et de troubles métaboliques. Dans ce contexte, il devient opportun de maintenir un équilibre, tant au niveau cellulaire qu’organique, pour préserver la santé à long terme.
A lire auusi >>>>>8 solutions pour renforcer votre immunité naturellement<<<<<
Retour à l’équilibre : Vers une médecine préventive et réparatrice
Il est de plus en plus évident que la médecine moderne doit intégrer la notion d’équilibre cellulaire dans son approche thérapeutique. Cela signifie qu’au-delà des traitements symptomatiques, il est essentiel de prendre en compte le rôle central de l’autophagie et de l’apoptose dans la régulation de la santé.
Alimentation et santé cellulaire : Adopter une alimentation riche en antioxydants, fibres, acides gras essentiels, et micronutriments peut stimuler l’autophagie et renforcer l’efficacité de l’apoptose. Par exemple, des composés comme le resvératrol (présent dans le raisin et le vin rouge) et le sulforaphane (présent dans les crucifères comme le brocoli) ont montré qu’ils favorisent l’autophagie et préviennent les dommages oxydatifs.
Exercice physique et stimulation de l’autophagie : L’activité physique modérée et régulière stimule l’autophagie en activant des mécanismes cellulaires de nettoyage. L’exercice régulier a également un effet bénéfique sur le microbiote intestinal, renforçant la barrière intestinale et améliorant la régénération des cellules intestinales.
Complémentation et thérapies ciblées : Des études récentes ont montré que certains suppléments, comme le NAD+ (nicotinamide adénine dinucléotide) ou la spermidine, peuvent activer l’autophagie et améliorer la santé cellulaire. De même, certaines thérapies de modulation des voies de signalisation, telles que l’inhibition de mTOR ou la stimulation d’AMPK, sont actuellement explorées pour leur potentiel dans le traitement de maladies chroniques et de pathologies liées au vieillissement.
Conclusion : L’Autophagie et l’Apoptose, pièces incontournables de l’homéostasie cellulaire
En conclusion, l’autophagie et l’apoptose sont deux processus vitaux qui assurent l’équilibre cellulaire et, par extension, l’équilibre de l’organisme. Leur rôle dans le maintien de la santé est inestimable, et leur perturbation peut mener à une cascade de maladies dégénératives et de troubles immunitaires. Pourtant, en agissant sur les facteurs qui influencent ces processus, comme l’alimentation, l’exercice physique, et la gestion du stress, il est possible de stimuler ces mécanismes naturels et d’améliorer la santé globale.
Il est essentiel de comprendre que l’autophagie et l’apoptose, bien que distincts, sont intimement liés. Ils ne se remplacent pas, mais se complètent pour assurer une réponse cellulaire adaptée aux différents types de stress. À cet égard, l’intestin, en tant que principal site de digestion et de régulation immunitaire, est un exemple marquant de l’importance de ces processus. Lorsque l’équilibre cellulaire de l’intestin est perturbé, cela peut entraîner des dysfonctionnements à l’échelle de tout l’organisme.
Pour les praticiens de santé, cela représente une invitation à aller au-delà des approches symptomatiques et à promouvoir des stratégies thérapeutiques qui respectent et soutiennent ces mécanismes biologiques naturels. La connaissance des liens entre autophagie et apoptose, ainsi que leur rôle dans la régénération et la protection des cellules, peut offrir de nouvelles perspectives pour traiter et prévenir de nombreuses pathologies. La santé de l’individu dépend en grande partie de la capacité de son corps à maintenir cet équilibre cellulaire, et un retour à un mode de vie plus en harmonie avec les processus naturels pourrait être la solution d’une meilleure santé et d’un vieillissement réussi.
Sources scientifiques :
Levine, B., & Kroemer, G. (2008). « Autophagy in the Pathogenesis of Disease. » Cell, 132(1), 27-42.
Cet article fondamental explique les bases biologiques de l’autophagie et son rôle dans diverses pathologies, y compris les maladies neurodégénératives et le cancer.
[DOI: 10.1016/j.cell.2007.12.018]
Mizushima, N., & Komatsu, M. (2011). « Autophagy: Renovation of Cells and Tissues. » Cell, 147(4), 728-741.
Cette revue approfondie explore les mécanismes moléculaires de l’autophagie et son rôle dans la régénération cellulaire et le maintien de l’homéostasie.
[DOI: 10.1016/j.cell.2011.10.026]
Elmore, S. (2007). « Apoptosis: A Review of Programmed Cell Death. » Toxicologic Pathology, 35(4), 495-516.
Une revue détaillée sur l’apoptose, ses mécanismes moléculaires et son rôle dans la régulation des cellules saines et malades.
[DOI: 10.1080/01926230701320337]
Vanden Berghe, T., et al. (2014). « Autophagy and apoptosis: novel therapeutic targets in inflammatory diseases. » Scientific World Journal, 2014, 236475.
Cet article explore les liens entre autophagie et apoptose dans le cadre des maladies inflammatoires et la recherche de nouvelles approches thérapeutiques.
[DOI: 10.1155/2014/236475]
Nakamura, S., & Yoshimori, T. (2018). « Autophagy and the immune system. » Nature Immunology, 19(5), 540-548.
Un article qui discute des effets de l’autophagie sur le système immunitaire, avec des implications spécifiques pour les maladies auto-immunes et inflammatoires, y compris dans l’intestin.
[DOI: 10.1038/s41590-018-0134-2]
Sajid, S., et al. (2020). « Autophagy and its Role in Cancer. » Pathology Research International, 2020, 8356079.
Cette revue se concentre sur l’interaction entre autophagie et cancer, mettant en lumière les recherches récentes sur la manipulation de ces processus dans le traitement du cancer.
[DOI: 10.1155/2020/8356079]
Carmona-Fontaine, C., et al. (2013). « Apoptosis and autophagy in cancer and disease. » Cell Death & Disease, 4(8), e730.
Une exploration des interactions entre apoptose et autophagie dans le contexte des maladies chroniques et dégénératives, y compris les cancers.
[DOI: 10.1038/cddis.2013.220]
Hochwagen, A., & Nussbaum, M. (2009). « The role of apoptosis and autophagy in cancer prevention and therapy. » Journal of Clinical Oncology, 27(18), 3940-3947.
Cet article examine les liens entre les mécanismes de réparation cellulaire, de suppression tumorale et les stratégies thérapeutiques en oncologie.
[DOI: 10.1200/JCO.2008.20.5922]
Leung, S. W., et al. (2015). « The Impact of Lifestyle on Gut Microbiota and Intestinal Autophagy. » Frontiers in Physiology, 6, 222.
Cette étude se penche sur la façon dont les habitudes de vie, telles que l’alimentation et l’exercice, influencent la fonction de l’autophagie dans l’intestin et leur lien avec les maladies digestives et métaboliques.
[DOI: 10.3389/fphys.2015.00222]